ИММУНОКОРРЕКТОР ДЛЯ ЖИВОТНЫХ
РОНКОЛЕЙКИН®
РЕКОМБИНАНТНЫЙ ИНТЕРЛЕЙКИН-2
+7(911)916-02-00
vet@biotech.spb.ru
Вестник Астраханского государственного технического университета.
2007. № 4(39), июль-август. Астрахань: Изд-во АГТУ, 2007. С.103-109.
УДК 639.371.2: 591.1
Влияние рекомбинантного интерлейкина-2 на физиологические показатели гибрида белуга х стерлядь (бестер) после хирургического вмешательства для оценки развития гонад
С.Ю. Касаева, Е.А. Федосеева ФГУП НПЦ «БИОС»
Систематическое воздействие стрессирующих факторов на осетровых рыб, выращиваемых в условиях аквакультуры, способствует развитию иммунодефицитных состояний. При этом страдает не только гуморальное, но и клеточные звенья иммунитета. Главным образом это касается клеток иммунного надзора – лимфоцитов [1; 2; 3; 4].
В связи с этим особую актуальность приобретает профилактика и лечебная терапия экологически чистыми, безопасными для человека медикаментозными средствами группы иммуномодуляторов, обладающих иммуностимулирующими свойствами и способствующих устранению Т- клеточных дефицитов.
Интерлейкины являются неспецифическими препаратами и имеют по сравнению с интерфероном большие потенциальные возможности использования в качестве терапевтических препаратов для коррекции Т-клеточных дефицитов. Компоненты системы IL координировано вовлечены в регуляцию иммунного ответа и необходимы для дифференцировки, активации Т и B – лимфоцитов и других клеток иммунного ответа и интегрированы в цитокиновую сеть [5]. Мишенями регуляторного действия IL-2 являются различные субпопуляции Т-клеток, В-клетки, натуральные киллерные клетки, макрофаги [6]. В последние годы в медицине и ветеринарии широко используется отечественный генно-инженерный аналог интерлейкина-2 – рекомбинантный интерлейкин-2 (rIL-2) «Ронколейкин», производство ООО «БИОТЕХ», Санкт-Петербург. Рекомбинантный интерлейкин-2 (rIL-2) применяют в качестве иммунокорректора при различных инфекционных, гнойно-воспалительных, кожных, онкологических заболеваниях, постоперационных осложнениях и их профилактике, при заболеваниях глаз, дыхательных путей, воздействии стресс - факторов, в качестве адъюванта вакцин [7; 8].
Поскольку при операциях, осуществляемых в осетроводстве при получении половых продуктов и прижизненной оценке гонад, существует риск возникновения постоперационных осложнений на фоне снижения клеточного иммунитета, то на производственной базе ФГУП НПЦ по осетроводству «БИОС» была проведена экспериментальная работа по изучению влияния рекомбинантного IL-2 на физиологические показатели гибрида белуга х стерлядь (бестер).
Материалы и методы исследования
Объектом исследования являлся гибрид «белуга х стерлядь» - бестер (Asipenser nikoljukini). Материалом исследования послужили 2-х годовики данного гибрида. Для эксперимента были сформированы 3 группы рыб, которым была сделана лапаротомия с биопсией гонад. В группе «опыт 1» 10-ти рыбам вводили внутривенно Ронколейкин в дозе 1000 МЕ/кг массы тела; группе «опыт 2» 10-ти рыбам - 2000 МЕ/кг однократно, непосредственно после взятия крови из хвостовой вены перед операцией. Бестерам группы «контроль» (11 экз.) после операции также однократно, вводили окситетрациклин пролонгированного действия – нитокс, в дозе 0,1 мл/кг биомассы. Все особи были индивидуально помечены.
При клиническом осмотре рыб оценивали состояние шва, меток, жабр, кожных покровов, характер слизеотделения и учитывали поведенческие реакции.
Отбор проб крови у двухлеток бестера осуществляли пункцией хвостовой вены. Подсчет форменных элементов крови проводили унифицированным методом в счетной камере Горяева, СОЭ - по методу Панченкова. Мазки крови фиксировали раствором Майн-Грюнвальда и докрашивали азур-эозином по Романовскому. Подсчет лейкоцитарной формулы проводили по методике Ивановой (1983) [9]. Уровень гемоглобина в крови определяли гемоглобинцианидным методом. Содержание общего белка в сыворотке крови исследовали биуретовым методом, альбумина – по реакции с бромкрезоловым зеленым. Лизосомально-катионный тест (ЛКТ) проводили по методу Пигаревского В.Е. (1981) [10]. Уровень иммуноглобулинов определяли по унифицированной методике Воловенко М.А. (1975) [11]. В работе использовали диагностические наборы фирмы «Агат-Мед», «Ольвекс», «Лахема».
Результаты клинического осмотра бестеров в условиях эксперимента
Визуальное наблюдение за состоянием и поведенческими реакциями рыб проводили с первого дня после операции. В начале эксперимента каких-либо отклонений у рыб не выявлено. Повторному ихтиопатологическому осмотру рыба подверглась только на пятнадцатые сутки во избежание дополнительного стресса и травматизации оперированных особей. При этом у всех бестеров отмечено воспаление в области шва (табл. 1).
Таблица - 1. Клиническая картина операционных швов у бестеров в условиях эксперимента
Доза и наименование препарата |
Состояние шва в баллах |
Всего рыб экз. |
Сутки |
||
15 |
30 |
45 |
|||
rIL-2 1000 МЕ/кг массы тела |
- |
10 |
- |
4 |
8 |
+ |
- |
3 |
2 |
||
++ |
3 |
2 |
- |
||
+++ |
7 |
1 |
- |
||
rIL-2 2000 МЕ/кг массы тела |
- |
10 |
- |
5 |
8 |
+ |
- |
3 |
2 |
||
++ |
4 |
2 |
- |
||
+++ |
6 |
- |
- |
||
Окситетрациклин 0,1 мл/кг |
- |
11 |
- |
2 |
5 |
+ |
2 |
1 |
6 |
||
++ |
5 |
5 |
- |
||
+++ |
4 |
3 |
- |
||
Примечание- (-) рубцевание разреза, снятие швов; (+) гиперемия тканей, отечность; (++) гиперемия тканей, отечность, выделение сукровицы; (+++) гиперемия тканей, отечность, выделение сукровицы, некроз тканей
У рыб из 1-й и 2-й групп зафиксирована клиническая картина, характерная для острой фазы воспалительного процесса в области разреза и наложения швов (значительная гиперемия, покраснение, очаговый некроз покровных и подлежащих тканей, выделение кровянистого экссудата), снижение мышечного тонуса, вялость; в области брюшных жучек, хвостового стебля и меток потертости и у некоторых особей - петехии. У большинства рыб из третьей группы, инъецированных окситетрациклином пролонгированного действия, воспалительная реакция была менее выраженная, края разрезов были ровными, с незначительной гиперемией тканей и выделением сукровицы. Также у этих особей отмечено снижение мышечного тонуса и ответной реакции на раздражители.
На тридцатые сутки у гибридов из 1 и 2 групп зарегистрировано улучшение состояния швов; при этом выявлена повышенная регенерация покровных и подлежащих тканей, прекращение некротических процессов. Кроме того, у этих групп рыб отмечена усиленная реакция на раздражители. У контрольных оперированных особей, наоборот, было зафиксировано некоторое ухудшение физиологического состояния: наблюдали активизацию воспалительных процессов в раневой области (таблица 3), а также покраснение хвостового стебля в месте предыдущего забора крови. На промежуточном ихтипатологическом осмотре у некоторых экспериментальных особей, в связи с удовлетворительным состоянием, были сняты швы. В большей мере это касалось рыб, которым вводили Ронколейкин в дозе 2000 ед./кг.
На сорок пятые сутки, при очередном взятии крови, у всех оперированных рыб были сняты швы, однако у контрольных особей все же оставались признаки воспалительных процессов.
Гематологические показатели бестеров в условиях эксперимента
Уровень гемоглобина в крови (Hb г/л) в начале эксперимента был различен при (p<0,05) между всеми группами (табл. 2). В дальнейшем, достоверных различий не выявлено. Концентрация Hb (г/л) у рыб из всех экспериментальных групп (p<0,05) снижалась в течение тридцати дней и повысилась только к концу эксперимента.
При анализе содержания эритроцитов в крови и содержания гемоглобина в одном эритроците (табл. 2) выявлено, что в данном случае компенсация гемоглобина после операционной и постоперационой кровопотери осуществлялась различными путями.
Таблица 2. Гематологические показатели бестеров в условиях эксперимента
Вариант |
Показатели |
0 сутки |
15 сутки |
30 сутки |
45 сутки |
Опыт 1 |
Hb ± m (г / л)
|
68,21±5,18* |
62,50±5,22 |
49,27±4,50 |
68,40±5,77 |
Опыт 2 |
93,85±5,19* |
68,69±5,74 |
57,00±2,30 |
83,09±4,49 |
|
Контроль |
85,77±3,79 * |
74,26±4,45 |
59,29±3,87 |
88,43±9,74 |
|
Опыт 1 |
|
0,97±0,05* |
0,81±0,07* |
0,79±0,09 |
0,86±0,06* |
Опыт 2 |
1,07±0,05 |
1,16±0,10* |
0,75±0,08 |
0,90±0,06* |
|
Контроль |
1,22±0,07* |
0,94±0,13* |
0,90±0,11 |
1,00±0,08* |
|
Опыт 1 |
Hb/Er пкг
|
60,50±4,38* |
80,99±6,68* |
65,05±4,15 |
82,55±8,78 |
Опыт 2 |
88,39±4,85* |
55,26±6,06* |
73,71±6,18 |
95,03±9,42 |
|
Контроль |
71,77±4,18* |
87,99±10,32* |
70,74±4,83 |
92,29±10,91 |
|
Опыт 1 |
Le±m; 10-12л
|
0,0 3 ±0,01 |
0, 21 ±0,0 5 |
0, 17 ±0,03 |
0, 07 ±0,02* |
Опыт 2 |
0,0 4 ±0,02 |
0, 23 ± 0 , 05 * |
0, 16 ±0,05 |
0, 07 ±0,01* |
|
Контроль |
0,0 4 ±0,02 |
0,16±0 , 0 1 * |
0,21±0,06 |
0,14±0,05* |
Примечание - (*) различия достоверны (p<0,05)
В первые пятнадцать суток у групп 1 и 3 этот процесс происходил на фоне снижения общего числа эритроцитов за счет увеличения Hb в одном эритроците, а у группы рыб, инъецированной Ронколейкином в дозе 2000 ед./кг - за счет увеличения эритроцитов в крови на 43,2 и 23,4% относительно групп рыб (опыт 1) и контроля. На тридцатые сутки наблюдали противоположную картину - у группы (опыт 2) отмечено увеличение концентрации гемоглобина в одном эритроците на 4,0 и 13,0% относительно опыта-1 и контроля, при снижении количества эритроцитов крови. При этом, в этот период был зафиксирован минимальный уровень гемоглобина в крови у всех экспериментальных групп бестеров.
Абсолютное количество лейкоцитов в крови рыб опытных вариантов на 15 сутки было в 1,3 и 1,4 раза больше контрольного варианта, причем различия между контролем и опытом 2 были при (p<0,05). На тридцатые сутки так же зарегистрированы различия между этим показателем, но они были не достоверны. На сорок пятые сутки уровень лейкоцитов в крови рыб из контрольной группы превысил в 2,0 раза аналогичные показатели опытных вариантов (p<0,05). Динамика уровня лейкоцитов в крови четко отражает состояние рыб после операции в различных вариантах эксперимента и соответствует клинической картине в области шва.
Скорость оседания эритроцитов (СОЭ) у рыб в норме составляет 2-10 мм/ч и напрямую зависит от многих обстоятельств: температуры воды, ее бактериального фона, наличия стрессующих факторов и общего физиологического состояния организма рыб. В нашем случае, скорость оседания эритроцитов у оперированных рыб была в пределах физиологической нормы и колебалась в экспериментальный период от 2 до 8 мм/ч. Однако, при анализе СОЭ у оперированных рыб, инъецированных различными препаратами, обнаружено, что максимальные значения этого показателя зарегистрированы на пятнадцатые сутки у особей, которым внутривенно вводили Ронколейкин, что соответствует наблюдаемой клинической картине воспалительных процессов в области шва. При этом скорость оседания эритроцитов в группах (опыт 1 и опыт 2) была выше на 29,3 и 21,1%, соответственно по группам, относительно контроля. Максимальные значения СОЭ у рыб с инъекцией антибиотика зарегистрированы на тридцатые сутки, что так же согласуется с результатами ихтиопатологического осмотра бестеров.
Физиолого-иммунологические показатели бестеров в условиях эксперимента
Детальное изучение основных белковых фракций сыворотки крови показало, что в послеоперационный период концентрация общего белка снижалась при p<0,05 на 33,4; 20,9; 34,7% в течение тридцати суток у всех групп рыб в основном за счет альбуминовой фракции, соответственно по группам – опыт 1, опыт 2, контроль. Причем уровень иммуноглобулинов (Ig) увеличивался на 18,6; 22,5; 22,5% соответственно по 1, 2, 3 группам рыб (табл. 3).
Таблица 3. Физиологические показатели бестера в условиях эксперимента
показатели |
0 сутки |
15 сутки |
30 сутки |
45 сутки |
|
Опыт 1 |
Алб± m, (г/л)
|
11,99±0,71 |
8,58±0,20 |
8,24±0,30 |
11,21±0,21 |
Опыт 2 |
11,27±0,29 |
8,50±0,40 |
9,06±0,33 |
11,36±0,22 |
|
Контроль |
11,21±0,13 |
9,93±0,28 |
9,31±0,40 |
10,72±0,31 |
|
Опыт 1 |
ОБ± m , (г / л)
|
31,17±0,95 |
25,97±1,20 |
20,77±1,06 |
29,16±0,82 |
Опыт 2 |
29,98±2,46 |
27,72±1,15 |
23,72±1,38 |
29,31±0,60 |
|
Контроль |
31,18±1,92 |
26,37±1,07 |
20,35±1,33 |
26,07±1,33 |
|
Опыт 1 |
Ig ± m , (г / л)
|
7,06±0,27 |
8,21±0,18 |
8,37±0,23 |
6,73±0,34 |
Опыт 2 |
7,11±0,24 |
8,37±0,24 |
8,90±0,24 |
6,48±0,19 |
|
Контроль |
6,95±0,26 |
8,00±0,22 |
8,71±0,26 |
6,49±0,45 |
|
Опыт 1 |
Ig/ ОБ ± m , (%)
|
22,81±1,04 |
26,62±1,16 |
32,98±1,97 |
23,50±2,10 |
Опыт 2 |
24,55±1,33 |
28,87±1,47 |
35,65±1,86 |
28,11±1,74 |
|
Контроль |
23,80±1,60 |
27,50±1,96 |
32,08±1,92 |
33,69±3,84 |
Динамика концентрации альбуминов в сыворотке крови свидетельствует о том, что у рыб после длительной зимовки с отсутствием питания и лапаротомии наблюдается снижение белков (p<0,05), выполняющих транспортную и резервную функции на 31,3; 19,6; 16,8% соответственно по группам рыб (опыт 1, опыт 2, контроль). Кроме того, это может свидетельствовать об активной регенерации тканей в раневой области. Причем к сорок пятым суткам уровень альбуминов возрастал, это подтверждает завершение репарационного процесса.
Таким образом, анализ концентраций основных белковых фракций сыворотки крови оперированных бестеров из разных групп не выявил особых различий (p>0,05) после применения иммунокорректора и антибиотика.
Показатели лизосомально-катионного теста и клеток белой крови и у бестеров в условиях эксперимента.
Для оценки способности к фагоцитозу палочкоядерных нейтрофилов крови бестеров был использован лизосомально-катионный тест, в котором определяли содержание лизосомальных катионных белков (ЛКБ) по среднему цитохимическому коэффициенту (СЦК). Полученные данные свидетельствуют (табл. 4), что в дооперационный период СЦК нейтрофилов у всех групп бестеров был в пределах нормы и соответствовал по пятибалльной шкале пяти баллам.
Таблица 4. Лизосомально-катионный тест бестеров в условиях эксперимента СЦК ± m; у.е
Варианты |
0 сутки |
15 сутки |
30 сутки |
45 сутки |
Опыт 1 |
1,19±0,09 |
0,60±0,07 |
0,64±0,14 |
0,54±0,05 |
Опыт 2 |
1,31±0,07 |
0,58±0,06 |
0,50±0,05 |
0,70±0,06* |
Контроль |
1,24±0,12 |
0,44±0,05 |
0,49±0,08 |
0,51±0,06 |
Примечание – «*» различия достоверны (p<0,05)
В дальнейшем, у всех бестеров из групп, подвергнутых лапаротомии, отмечена супрессия функциональной активности палочкоядерных нейтрофилов, при этом СЦК снижался (p<0,05) и был оценен, как неудовлетворительный (2 балла). На 15-30 сутки в крови бестеров наблюдали увеличение числа гранулоцитов со сниженной способностью к фагоцитозу. Так, у групп рыб, инъецированных rIL-2 в обеих дозах при увеличении численности палочкоядерных нейтрофилов в 2,3 и 2,2 раза СЦК снизился в 1,9 и 2,3 раза. У бестеров, инъецированных антибиотиком, уровень ПЯН возрос в 1,8 раза, а СЦК уменьшился в 2,9 раза, это, вероятно, обусловлено не только оперативным вмешательством, как в первых двух случаях, но и дополнительным ингибированием окситетрациклином нейтропоэза и его негативным воздействием на формирование гранулоцитов способных к фагоцитозу. Отмечено, что при повышении лимфоцитов в крови увеличивается и СЦК лизосомально-катионных белков нейтрофилов. Коэффициент корреляции между СЦК ЛКТ нейтрофилов и уровнем лейкоцитов в крови бестеров составил 0,72. На сорок пятые сутки зарегистрировано некоторое увеличение среднего цветного коэффициента ЛКБ у группы особей, инъецированных rIL-2 в дозе 2 тыс.МЕ/кг, до уровня 0,7, что соответствует по пятибалльной шкале - 4-м (хорошо). Тогда как, у рыб из групп опыт -1 и контроль этого не зафиксировано. Значения СЦК у бестеров второй группы свидетельствуют о более раннем восстановлении организма после оперативного вмешательства, в том числе фагоцитарной функции гранулоцитов, по сравнению с рыбами первой и третьей групп.
Микроскопия мазков крови подопытных бестеров показала, что в начале эксперимента лейкоцитарный профиль рыб были относительно идентичен (рис. 1). При этом отмечена лейкопения.
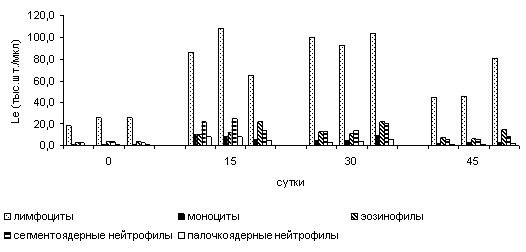
Примечание - «*» - различия достоверны ( p <0,05); «**» - различия достоверны ( p <0,001)
Рисунок 1. Лейкоцитарный профиль бестеров в условиях эксперимента
На пятнадцатые сутки отмечено перераспределение лейкограммы в сторону нейтрофилии (p<0,05) у всех групп оперированных особей, при этом основную долю нейтрофильных гранулоцитов составляли палочкоядерные формы, а в абсолютных показателях – сементоядерные. Также у групп 1 и 2 увеличилось содержание моноцитов в 2,1 и 1,7 раза. Относительное число эозинофилов, напротив, уменьшилось в 2 и 1,1 раза, а в абсолютных значениях увеличилось в среднем в 3,5 раза. У рыб, инъецированных окситетрациклином, наблюдали аналогичные изменения в крови. Однако, количество эозинофилов превысило типичные показатели в 6,0 раз (p<0,05), что, по всей видимости, обусловлено некоторой интоксикацией организма, вызванной окситетрациклином. При сопоставлении данных лейкограмм с клинической картиной в операционной области, выявлено, они характеризуют неодинаковую клиническую картину - острое воспаление у рыб, инъецированных Ронколейкином, и вялотекущую воспалительную реакцию у бестеров с инъекцией окситетрациклина. На тридцатый день исследований в лейкоцитарной формуле обнаружено, что лейкограммы рыб всех вариантов практически одинаковы и был отмечен четкий лимфоцитарный профиль, но у рыб из группы контроля зарегистрировали стабильную эозинофилию. Абсолютное количество эозинофилов в крови бестеров проинъецированных окситетрациклином составляло в среднем 22,4 тыс.шт./мкл. Это, возможно, объясняется повышением уровня токсичных веществ в воде, поскольку, как было сказано ранее, экспериментальный период совпал с половодьем. Активная пролиферация лимфоцитов (p<0,05) у рыб из опытных вариантов, видимо, обусловлена активным влиянием ключевого провоспалительного цитокина (ИЛ-2), тогда как у оперированных контрольных особей этот процесс был менее выражен. К сорок пятым сутками наблюдался относительный баланс в формуле белой крови у групп особей, инъецированных Ронколейкином и окситетрациклином, но у последней все же зарегистрировано более высокое содержание лимфоцитов в абсолютных числах – в 1,9 раза и эозинофилов 2,2 раза при (p<0,05).
Заключение
Таким образом, неравнозначность клинической картины воспалительной реакции у бестеров из разных групп в течение экспериментального периода косвенно может свидетельствовать о перераспределении функциональной активности групп лимфоцитов. Несмотря на то, что отсутствуют данные по количественному соотношению Т и В - популяций лимфоцитов в крови осетровых и по сравнению с лейкоцитарной формулой теплокровных имеются явные отличия, мы склонны считать, что схема действия rIL-2 идентична схеме присущей гомотермным организмам. Кроме того, активная регенерация тканей опытных рыб и более ранние сроки репарации, также могут быть определены терапевтическим эффектом rIL-2.
У оперированных бестеров, инъецированных Ронколейкином® в дозе 2000 МЕ/кг массы тела, отмечено усиление эритропоэза, в то время как компенсация концентрации гемоглобина в крови других групп оперированных рыб проходила за счет увеличения уровня гемоглобина в одном эритроците. Это может свидетельствовать о стимуляции функциональной активности гемопоэтической ткани иммунокорректором.
В процессе исследований показателей клеток белой крови и содержания лизосомально-катионных белков в нейтрофилах экспериментальных рыб обнаружено позитивное влияние rIL-2 в дозе 2000 МЕ/кг на активную пролиферацию лимфоцитов и восстановление фагоцитарной функции нейтрофильных гранулоцитов.
Выводы
1. Показано, что влияние rIL-2 на физиологическое состояние осетровых рыб имеет дозозависимый характер.
2. Выявлено, что rIL-2 способствует активной регенерации поврежденных тканей осетровых рыб при хирургической травматизации и более ранним срокам репарации.
3. Обнаружено, что под влиянием rIL-2 происходит увеличение числа эритроцитов и лейкоцитов в крови, что свидетельствует о стимуляции функциональной активности гемопоэза.
4. Зарегистрировано позитивное влияние rIL-2 на клеточный иммунитет в первую очередь на активную пролиферацию лимфоцитов и восстановление фагоцитарной функции нейтрофильных гранулоцитов осетровых рыб. Координируя межклеточные взаимодействия, он обеспечивает повышение устойчивости организма к вторичным инфекциям.
СПИСОК ЛИТЕРАТУРЫ
- Вихман А.А. Системный анализ иммунофизиологической реактивности рыб в условиях аквакультуры / М.: «Экспедитор», 1996.
- Junko K., Takaji I. Cortisol directly inhibits neutrophil defense activates in tilapia (Oreochromis niloticus) // 9 th Inern.conf. «Diseases of fish and shellfish». Greece. Rodos. 2002.- p .293.
- Житенева Л.Д., Макаров Э.В., Рудницкая О.А. Основы ихтиогематологии (в сравнительном аспекте) // Ростов - на- Дону: Эверест, 2004.- 312 с.
- Головин П.П. Проблемы стресса у рыб в пресноводной аквакультуре: способы диагностики и коррекции// Сб. научн. трудов Болезни рыб, «ВНИИПРХ», - М.: -2004.-с.54-61.
- Хаитов Р.М., Пинегин Б.В. Иммуномодуляторы: механизм действия и клиническое применение/ М.: ГНЦ Институт Иммунологии ,2003, - 23с.
- Smith K.A. Interleukin-2: infection, impact and implication.// Science, 1988; 240: 1169.
- Hank J.A., Surfus J., Gan J. Distinct clinical and laboratory activity of two recombinant interleukin-2 preparations.// Clin . Cancer res . 1999; 5(2). Р. 281 – 289
- Козлов В.К. Ронколейкин®: биологическая эффективность, иммунокорригирующая и клиническая эффективность. СПб. 2002. 86 с.
- Иванова Н.Т. Атлас клеток крови рыб./ М.: Легкая и пищевая промышленность.1983.
- Пигаревский В.Е., Мазинг Ю.А. Лизосомально-катионные белки// Лаб. дело, 1981, №10, С.579-582
- Воловенко М.А. Определение уровня иммуноглобулинов в сыворотке крови новорожденных телят// Ветеринария.- 1975.-№4. С.39-40.
